Section.2
個々人の免疫学的差異を踏まえた創薬研究
ヒト臨床検体と動物モデルとしての遺伝子改変マウス、非ヒト霊長類サル検体をside by sideで比較検討しながら、ヒト臨床応用に直結するような免疫学的解析系の構築、バイオマーカーの探索、ならびに新規予防、治療法の確立などの展開を目指しています。大きくは、がん関連研究と感染症関連研究を柱としています。
- 1. エイズ根治を目指した免疫療法の開発
- 2. HTLV-1感染症(ATL/HAM)病態関連免疫ゲノム・オミクス解析
- 3. 新規COVID-19ワクチン開発研究
- 4. 万能インフルエザワクチンの開発
- 5. デング熱ワクチンの開発
- 6. B型肝炎ウイルス治療用ワクチンの開発
◆ 感染症関連
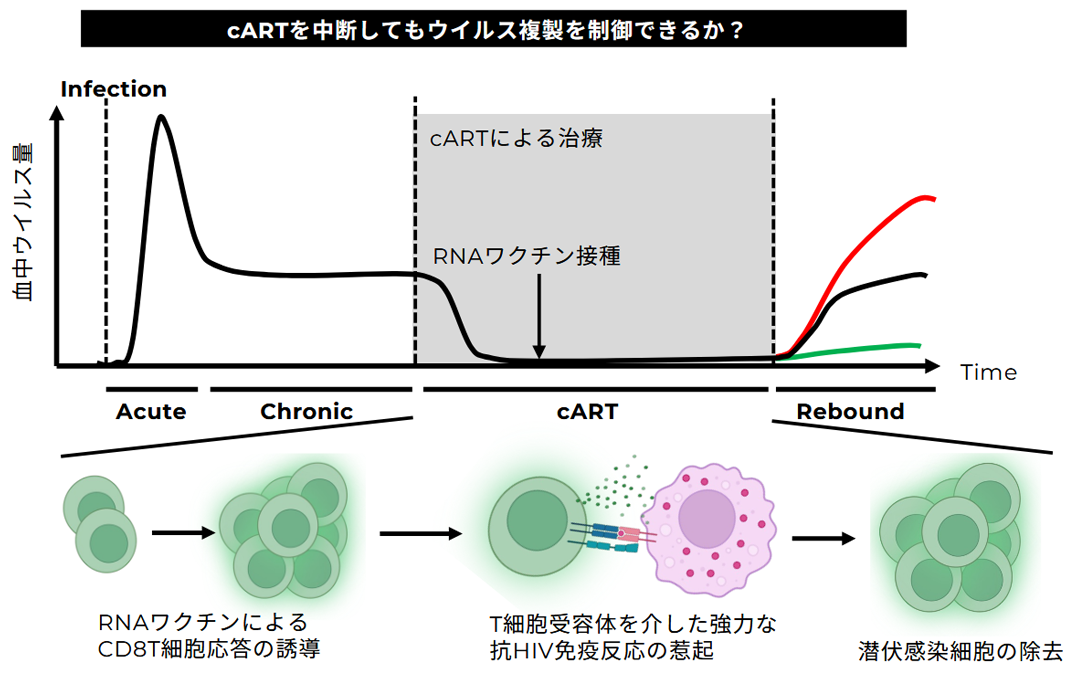
1. エイズ根治を目指した免疫療法の開発
HIVは後天性免疫不全症候群(エイズ)の原因ウイルスであり、同定から30年以上が経過した現在でも、世界で約3,500万人が感染しています。日本国内においても感染者数は増加傾向にあり、約2万人に達すると推定され、依然として重大な新興・再興感染症の一つです。エイズ治療については、これまでに複数の抗レトロウイルス薬が開発され、多剤併用療法(cART)の確立によって血中ウイルス量を検出限界以下に抑えることが可能となりました。しかし体内には「潜伏リザーバー」と呼ばれる潜伏感染細胞が残存し、治療を中断すると多くの場合にウイルスが再燃します。したがって、薬剤に依存せず長期にウイルスを抑制する「機能的治癒」を実現するためには、この潜伏感染細胞を免疫学的に制御・排除する必要があります。
私たちは、CD8 T細胞応答の強力な活性化を軸とした治療用RNAワクチンの基盤開発に取り組んでいます。鍵となる要素は次の2点です。
1)抗原設計:既存の知見に基づき、免疫原性が高く変異逃避に強いCD8 T細胞エピトープに焦点を当て、配列設計と配置を最適化する。
2)mRNAワクチンと併用するアジュバントの検討:HIV特異的CD8T細胞応答の量と質(多機能性、長期メモリー化等)の強化を目標に、自然免疫アゴニストの候補アジュバントを選定し、標準化した免疫評価系で併用効果と作用機序を検証する。
これらを組み合わせることで、HIV特異的CD8 T細胞を効率的に誘導し、潜伏リザーバーの縮小・機能抑制をめざします。最新の疫学データや臨床的ニーズを踏まえつつ、根治(機能的治癒)に近づく新たな免疫療法の創出に挑戦しています。
エイズ根治を⽬指した免疫療法の開発
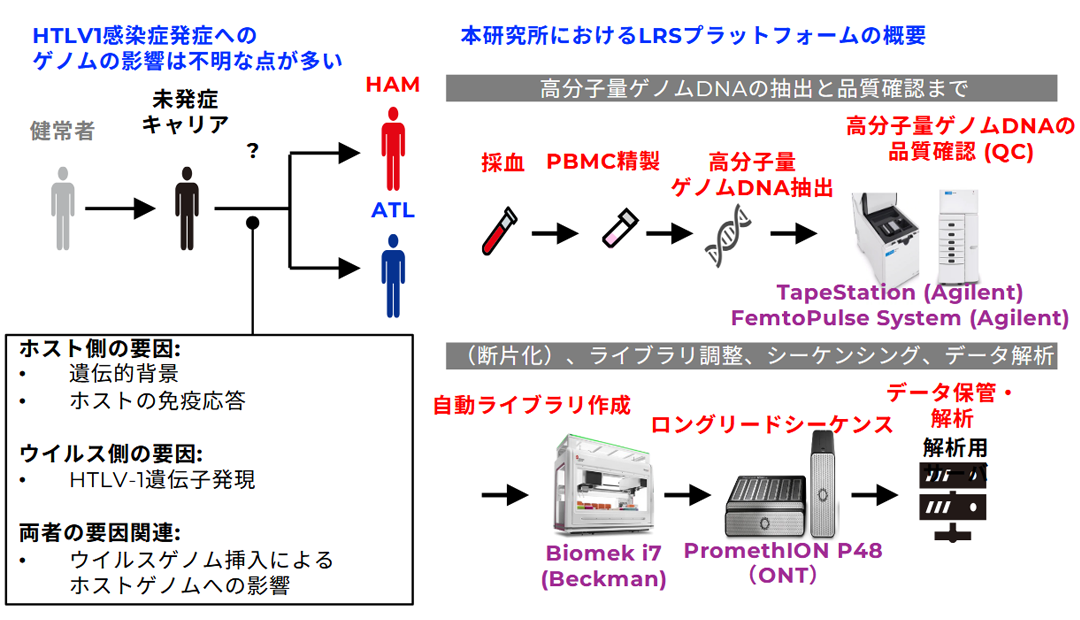
2. 研究内容:HTLV-1感染症(ATL/HAM)病態関連免疫ゲノム・オミクス解析
HTLV-1は日本を含む世界の一部地域に多くみられるウイルスで、一部の感染者では成人T細胞白血病(ATL)や脊髄疾患であるHAMを発症します。しかし、多くの感染者は生涯にわたり無症状のまま経過し、なぜ同じウイルス感染でも人によって結果が異なるのか、その理由は十分に解明されていません。
近年の技術進歩により、私たちは人の遺伝情報をこれまで以上に精密に解析できるようになってきました。本研究では最新の「ロングリードシーケンス」技術を軸に全ゲノム解析を行います。従来法ではDNAを短く断片化して解析するため、重要な変化を見逃す可能性がありましたが、ロングリードシーケンスはDNAを長い単位で読み取ることができ、複雑な構造や繰り返し配列も正確に解析可能です。これにより、HTLV-1関連疾患の発症に関与する新たな遺伝的要因を発見できる可能性があります。
さらに本研究では、ロングリード解析に従来手法を組み合わせることで幅広いデータを取得し、結果の信頼性を高めます。これにより発症機構の理解を深め、将来的にはリスク予測や新規治療法開発につながる知見を提供することを目指します。
HTLV-1関連疾患は日本で患者数が多いにもかかわらず、研究基盤が十分に整っていません。本研究は国内外に先駆けて新しい解析基盤を構築し、HTLV-1感染症の理解を大きく前進させ、リスク層別化や治療法開発へと発展させることが期待されます。最終的には患者さんと社会への貢献を目指します。
HTLV-1感染症(ATL/HAM)関連病態関連免疫ゲノム・オミクス解析
3. 新規COVID-19ワクチン開発研究
under construction
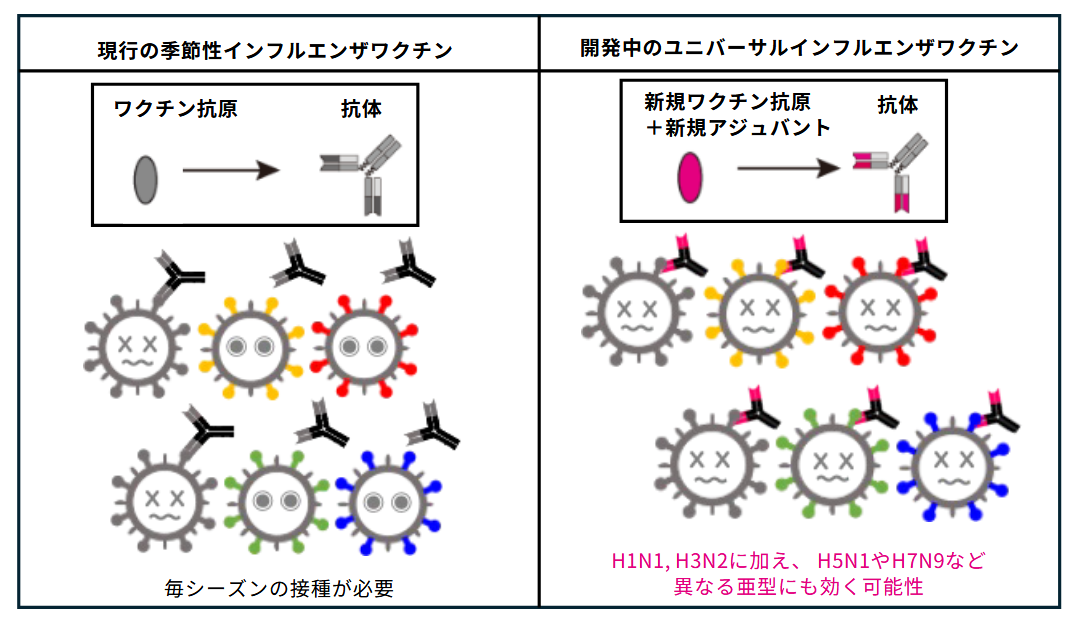
4. 万能インフルエンザワクチンの開発
現在、日本では毎年2,500万本以上の季節性インフルエンザワクチンが製造・接種されています。しかし、現行ワクチンで誘導される抗体はウイルスの「連続抗原変異」に十分対応できず、流行株に合わせた毎シーズンの接種が必要です。さらに高齢者では効果が限定的であり、2009年のパンデミックのように「不連続抗原変異」を有する新型ウイルスが出現した場合、十分な防御効果は期待できません。
この課題に対し、私たちは季節性インフルエンザワクチン接種者の検体を用い、HAステム領域に対するFc受容体依存的抗体応答を解析しました。その結果、接種によりHAステム領域特異的IgG抗体が誘導され、抗体依存性細胞傷害(ADCC)や抗体依存性貪食(ADCP)と相関することを確認しました。しかし、中和活性の幅は限定的であり、H5N1やH7N9など異なる亜型に対する交差中和は認められませんでした。すなわち、現行ワクチンは一定のHA定常領域応答を誘導するものの、広範な交差防御には新たな設計が必要であることが示唆されました。
そこで私たちは、国内のアカデミア・製薬企業と共同で、交差防御反応性に優れるような、いわゆる「ユニバーサルワクチン」の開発を進めています。本ワクチンは既にヨーロッパにおいて臨床試験が開始されています。
インフルエンザワクチンへの応用
5. デング熱ワクチンの開発
under construction
6. functional cureを目指したB型肝炎ウイルス治療用ワクチンの開発
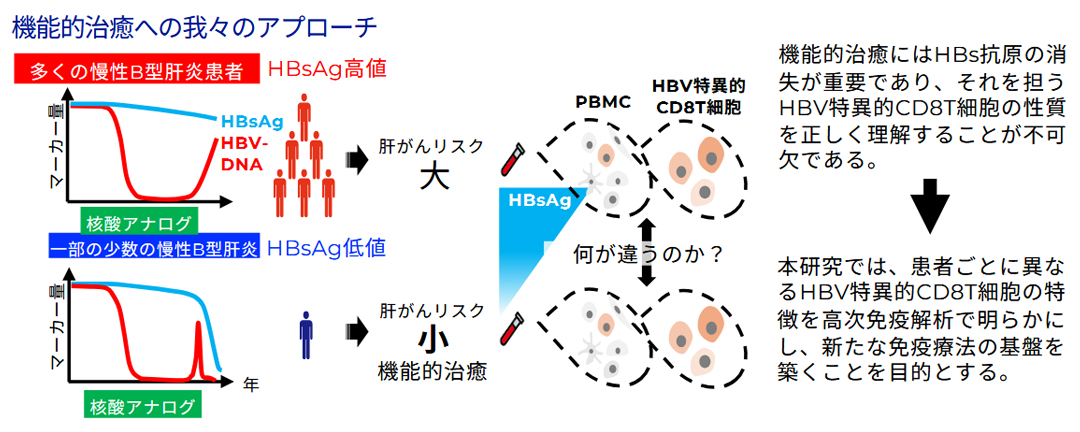
B型肝炎ウイルス(HBV)は、世界で約2.5億人(2022年WHO推定)が持続感染している極めて身近なウイルスです。慢性感染では一部の症例が肝硬変や肝がんに進展しますが、多くの感染者は無症状で経過し、その差には宿主免疫応答が深く関与していると考えられています。実際、健康な成人が初めてHBVに感染した場合、多くは自身の免疫によりウイルスを排除でき、さらにワクチンの有効性も免疫の重要性を裏付けています。
現在の治療では「核酸アナログ」が用いられ、体内ウイルス量を抑制することは可能ですが、完全排除には至りません。そのため、長期投与を継続しても肝細胞内にウイルスの痕跡が残存し、肝がんの原因となり得ます。特にHBV感染の指標であるHBs抗原は多くの患者で持続し、自然消失は数%にとどまります。HBs抗原の残存は将来的な発がんリスクと関連しており、臨床的治療目標はHBs抗原の消失に置かれています。
近年は、ウイルスの完全排除が困難であることから、免疫によるウイルス抑制と肝炎沈静化を目指す「機能性治癒」が新たな治療ゴールとされています。その実現には、肝臓に潜む感染細胞を免疫応答によって制御・排除する必要があります。私たちはこれまでに、HBV特異的CD8T細胞の中で特定の性質をもつ細胞の頻度がHBs抗原量と相関し、「機能性治癒」の指標となり得ることを見出しました。そこで現在、HBV特異的T細胞を効果的に活性化することを目的とした新規ワクチンの開発に取り組んでいます。本ワクチンはHBVの複数抗原を利用し、より強力で持続的な免疫応答を誘導できるように設計されています。
functional cureを目指したB型肝炎ウイルス治療用ワクチンの開発

◆ がん関連
1. mRNA/saRNA モダリティを用いた免疫療法開発のための基盤構築
私たちは、体内で抗原や治療用タンパク質を発現させる mRNA/saRNAモダリティ を基盤に、疾患や作用分子に応じて迅速に設計を切り替えられる 汎用プラットフォーム の開発に取り組んでいます。saRNAは複製酵素を介して細胞内で自己増幅するため、少量の投与で長期間にわたる発現が得られる点が特徴です。配列設計・送達技術・評価系を一体的に最適化し、少ない投与量でも持続的かつ再現性の高い発現を実現するとともに、応答の質と安全性のバランスを丁寧に検証しています。
本プラットフォームは、ワクチンや免疫調節分子の提供など幅広い用途に対応できる 拡張性を重視しており、開発の各段階で得られた知見を設計指針として蓄積・再利用できる点が大きな強みです。さらに、この汎用性を活かし、搭載分子の一例として体内で抗体遺伝子を発現させるアプローチも視野に入れており、必要に応じて半減期やエフェクター活性を調整する“チューニング”も可能です。これにより、従来の精製抗体投与を補完する新たな選択肢としての可能性を追求しています。
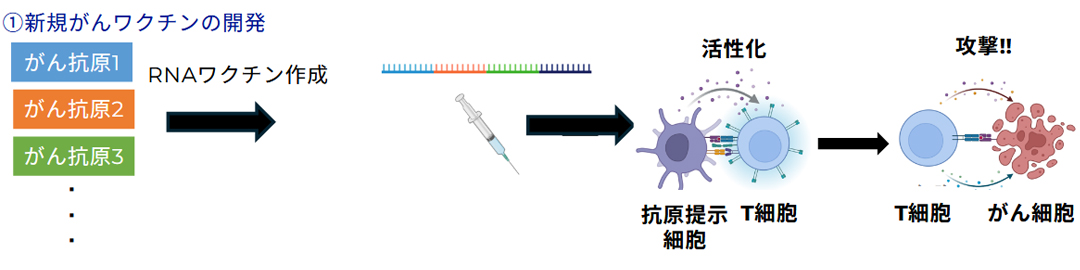
2. 難治性癌に対する新規がん免疫療法の開発
膵がんは消化器がんの中でも極めて予後不良で、5年生存率は10%未満とされています。手術や抗がん剤を組み合わせても再発率は60〜70%に達し、新たな治療戦略が必要です。近年、免疫療法が多くのがんで成果を示し、膵がんでも術後に良好な免疫応答を維持していると再発抑制につながると報告されています。しかし膵がん細胞は免疫監視から逃れる仕組みを発達させており、その克服が課題です。当研究室では、固形癌を対象とした新規がんワクチンの開発に取り組んでいます。
メラノーマ(悪性黒色腫)は皮膚や粘膜に発症する固形がんで、世界で年間約32万5千人が新規発症し、日本でも増加傾向にあります。分子標的薬や免疫チェックポイント阻害薬が登場したものの、すべての患者に十分な効果があるわけではなく、新規治療が求められています。特に、新型コロナで注目されたmRNAワクチン技術はがん治療にも応用可能であり、メラノーマに対する新しい治療として期待されています。我々はこの技術を基盤に、①多数の患者データから共通ネオアンチゲンを選定し抗原性を検証すること、②mRNAワクチンに免疫賦活化分子を組み合わせ免疫応答を強化すること、を柱に開発を進めています。これらを通じて、より効果的なメラノーマmRNAワクチンの臨床応用を目指しています。
難治性がんに対する新規がん免疫療法の開発
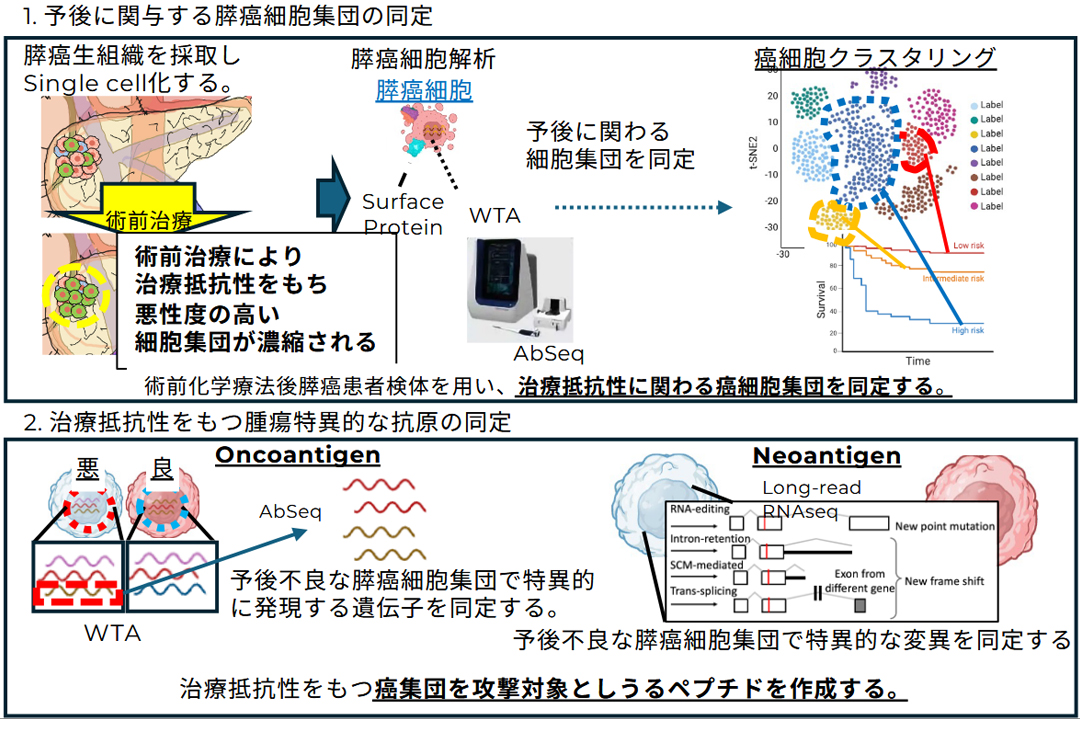
3. 膵がんをはじめとする難治性がんに対する免疫ゲノム・オミクス解析
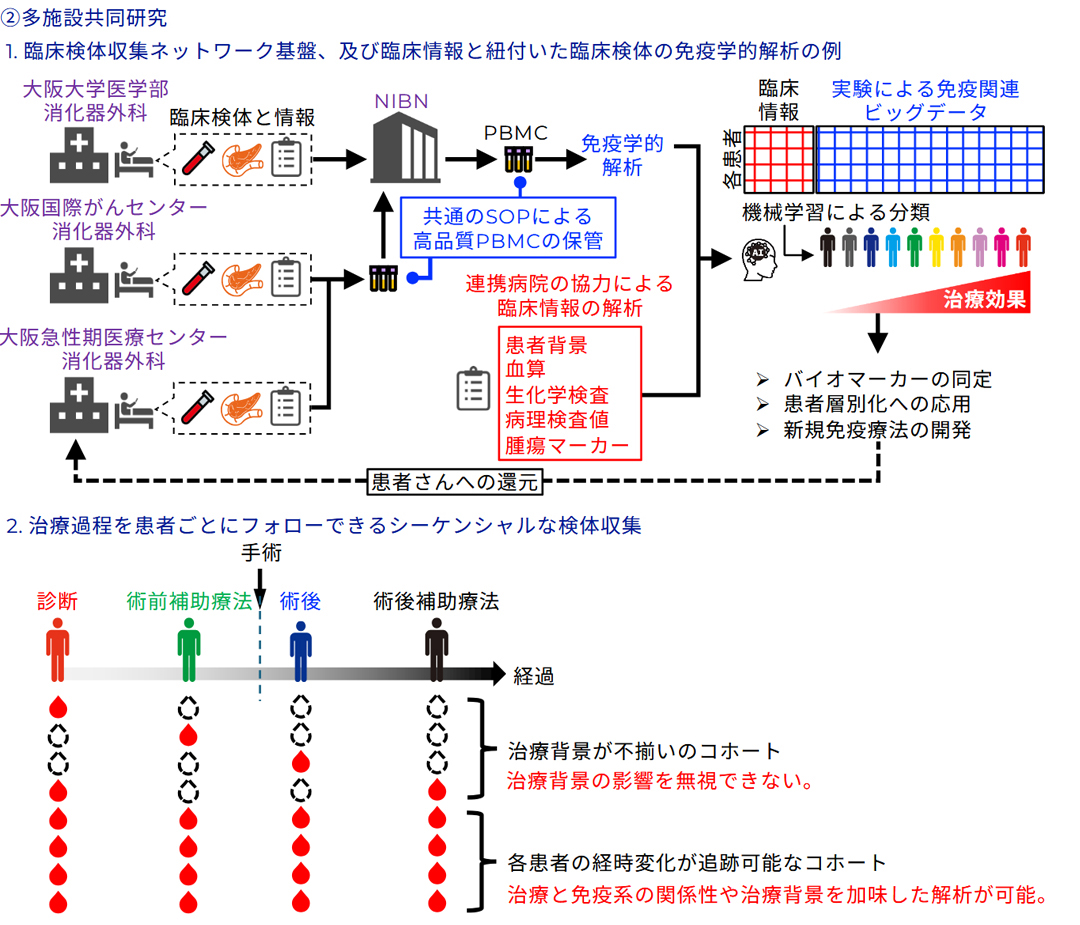
膵がんは依然として5年生存率が一桁台にとどまる極めて予後不良な腫瘍であり、外科的切除や化学療法の進歩にもかかわらず根治は困難です。免疫チェックポイント阻害剤をはじめとする免疫療法ががん治療の新しい柱となりつつある一方、膵がんにおいては有効例が限定的であり、なぜ免疫応答が抑制されるのか、またどのような腫瘍細胞集団が治療抵抗性を担っているのかは大きな未解決課題です。膵がんは高度に不均一な腫瘍であり、組織内には多様な性質をもつ細胞集団が混在して存在するため、個々の腫瘍細胞やそれに応答する免疫細胞を単一細胞レベルで解析し、予後や治療抵抗性と結びつく細胞集団を同定することが極めて重要です。
私たちはこの課題に挑むため、ゲノムから空間情報までを統合したマルチオミクス解析基盤を構築しています。具体的には、膵がん組織をシングルセル化し、AbSeqによる表面タンパク質解析とTCR-seqによる腫瘍浸潤T細胞のレパートリー解析を組み合わせることで、腫瘍細胞集団と免疫応答の関係性を包括的に捉えます。さらに、多重免疫染色(CODEX)による空間的免疫マッピングを行い、免疫細胞と腫瘍細胞の局在や近接関係を可視化することで、腫瘍微小環境の構造的基盤を明らかにします。加えて、long-read RNAシーケンスを用いて、予後不良な腫瘍細胞集団に特異的な遺伝子発現やスプライシング異常、ネオアンチゲン候補を探索し、治療標的となり得る新規抗原の同定を目指します。
これらの解析を統合することで、膵がんの治療抵抗性や予後不良に関わる細胞集団を高精度に特定し、それらを標的とする新たな免疫治療戦略を提案することが可能となります。本研究は膵がんにとどまらず、他の難治性がんにも展開できる汎用性をもち、難治がんに対する個別化免疫療法の基盤を築くものと期待しています。
膵がんをはじめとする難治性がんに対する免疫ゲノム・オミクス解析